趋势观察:生命科学领域伦理治理现状与趋势
|
|
中国网/中国发展门户网讯 生命科学是21 世纪发展最为迅速的学科领域之一,其新成果、新技术不断涌现,为人类社会带来了巨大的进步。同时,由于直接与“生命”密切相关,伦理问题也受到广泛关注,甚至诞生了专门研究生命科学领域人类行为道德哲学和伦理规范的学科——“生命伦理学”。本文关注生命科学领域的热点突破及其引发的伦理问题讨论,简要梳理各国涉及生命科学相关伦理问题的法律、法规、指南等治理规制,通过研判我国在生命科学领域相关伦理体系建设和举措,针对存在的问题和挑战,提出关于我国生命科学领域伦理治理的思考和建议。
生命科学领域伦理治理的总体态势
生命科学领域每一项突破性技术的诞生,如1998 年首次成功分离并体外培养人类胚胎干细胞、2010 年首个“人工合成生命细胞”的诞生、2015 年 CRISPR 基因编辑技术首次应用于人类胚胎编辑、2021 年成功在人体上进行猪肾移植试验等,都引发了人们对相关伦理和社会问题的广泛关注,并由此推动或促进全球各国伦理治理体系的建设,包括相关法律法规的出台和优化,以及相关伦理审查体系的完善等。然而,总体来看,生命科学领域相关伦理研究存在时滞性,且研究力度远远追不上科学研究快速发展的脚步。
生命科学领域新技术发展加速,相关伦理问题持续引发关注
从试管婴儿到辅助生殖,从胚胎干细胞到人体克隆,从合成生物到基因编辑胚胎,每当生命科学领域产生突破性的成果,并展现出巨大应用潜力时,都会基于各自不同的科学原理和应用场景引发一系列伦理问题讨论。
以基因编辑技术为例,虽然该技术的潜在科学价值已经得到广泛肯定,但其复杂的伦理和安全争议问题始终处在舆论热点。由于作用对象的复杂性、技术本身的敏感性,以及对健康、环境、经济、社会等方面影响存在的诸多不确定性及非预期效应,基因编辑可能引发的伦理风险是多层面的。随着 CRISPR-Cas9 为代表的基因编辑技术研究的深入,科学家们开始尝试在人类卵细胞、精子甚至胚胎上进行试验,基因编辑技术的伦理问题更加引人注目。尤其是2018 年世界首例“基因编辑婴儿”在中国诞生,引起国内外学术界和社会的广泛关注,引发基因编辑技术伦理和监管问题的巨大争议,更将基因编辑的伦理忧虑推上了高峰。同时,基因编辑技术可能带来的生物安全问题也吸引各方关注。例如,2016 年《美国情报界年度全球威胁评估报告》将“基因编辑”列入“大规模杀伤性与扩散性武器”威胁清单,认为这种有双重用途的技术分布广泛、成本较低、发展迅速,任何蓄意或无意的误用,都可能引发国家安全问题。
除了基因编辑技术,跨物种嵌合体研究进展迅速,伦理问题持续引发争议。由于全球器官移植资源极度缺乏,通过将人的多能干细胞植入其他动物的胚胎,在嵌合体上“养出”人类器官跨物种嵌合体,培养获得所需器官,成为再生医学领域最具吸引力的技术。早在2016 年 Science评选出的20 大技术预测中,人类与动物的嵌合体技术就位列其中。2019 年11 月底,全球首例“猪猴嵌合体”诞生;2021 年,全球首个“人猴嵌合体”胚胎诞生,揭开了人胚胎着床后发育的“黑匣子”。
尽管跨物种嵌合体研究蕴含重大价值,但也潜藏着巨大的伦理风险,其中争议较大的是嵌合体研究的边界问题。有学者认为,生殖细胞和神经细胞是人类-动物嵌合体的伦理界限。美国、西班牙等国家认为只要嵌合体不具备繁衍能力且不会发育出大脑,即可允许制造人-动物嵌合体。针对“人猴嵌合体”的研究,我国动物学家季维智认为,人猴嵌合胚胎绝不是人猴杂交——人猴嵌合胚胎是把猴子胚胎作为人干细胞发育的环境,本质上并未发生生殖嵌合,并不有悖伦理。西班牙发育生物学家阿方索·马丁内斯·阿里亚斯认为,相比猴子,用牛与猪来做研究“更具潜力,且不会有挑战伦理边界的风险”。同时,科学家们也强调,目前的研究只是停留在体外实验的阶段,如果人与动物嵌合体进入了体内实验,植入到动物体内,最后发育成某种生物,则后果不堪设想。
全球各国加强治理体系建设,不断达成伦理共识
生命科学领域颠覆性的新成果、新技术在带给人类进步的同时,都会引发人们对可能出现的潜在伦理和安全风险的思考和探讨,从而促使国际社会在生命科学领域的伦理治理方面不断进步和完善(图1)。
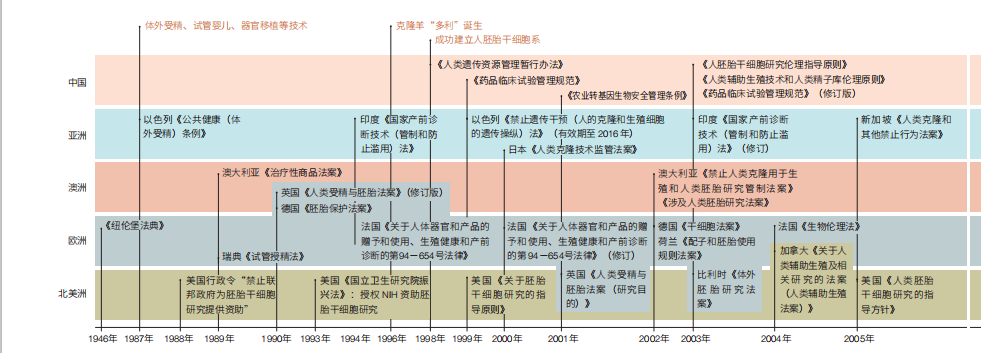

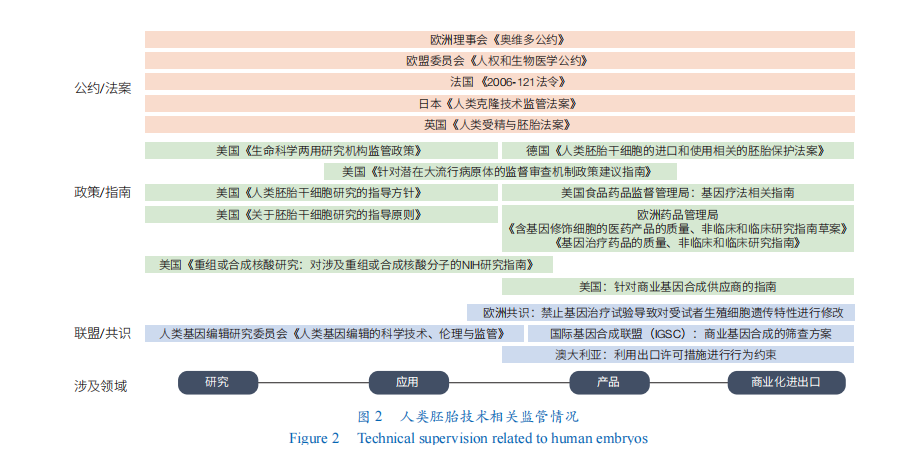
在新的技术风险出现时,各国基于本国的法律制度、历史传统和宗教信仰,纷纷制定了本国的生命科学领域伦理相关法律规定。尤其是对于干细胞和基因编辑等可能直接改变物种的新技术,世界各国已经通过多种措施监管和防范相关伦理问题,着力点主要在于涉及人类胚胎的科学研究管理、技术应用、操作规范,以及含有基因修饰或人工合成组分的医学产品的管理、商业化和进出口等多个层次(图2)。
1946 年在德国纽伦堡军事法庭上诞生的《纽伦堡法典》,明确了医生进行人体试验的10 条标准,开辟了人体试验规范化的先河。英国《人类受精与胚胎学法案》(1990 年发布,2008 年修订)是全球第一部涉及人类胚胎的相关监管法案;其修订版允许人类和动物“细胞融合”以创新“混合胚胎”的实验,对后续干细胞技术的研究发展有所促进。德国《胚胎保护法案》(1991年发布,2012 年修订)严格禁止人类胚胎干细胞研究及克隆胚胎干细胞;而德国《生殖医学法(草案)》(2000 年发布)再次强调在德国不允许进行胚胎干细胞的培养研究。日本2014 年起实施《再生医疗安全性确保法》,将使用诱导多功能干细胞和胚胎干细胞的临床研究和治疗划分为危险性最高的“第一类”,需由专门委员会进行审查。
除了国家层面的法律法规,各大国际组织纷纷出台各类指南或管理框架,通过实践指导,助力于科学共同体达成共识、自觉自治。例如,1964 年国际医学大会通过的《赫尔辛基宣言》规定在人体医学研究中,对受试者健康的考虑应优先于对科学研究的兴趣,这为临床研究伦理道德规范奠定基石;国际医学科学组织理事会(CIOMS)于2016 年制定修订版《涉及人的健康相关研究国际伦理准则》,旨在从伦理学、医学产品开发及安全性方面来指导健康研究,促进公众健康;国际干细胞研究学会(ISSCR)于2021 年5 月发布更新版《干细胞研究和临床转化指南》,有机结合了基于干细胞的胚胎模型、人类胚胎研究、嵌合体、类器官和基因编辑等领域最新研究进展与临床伦理规范,为科学监管干细胞临床转化提出了切实可行的建议;2021 年7 月12 日,世界卫生组织(WHO)下属专家委员会发布《人类基因组编辑管治框架》和《人类基因组编辑建议》,首次提出了将人类基因编辑作为公共卫生工具的全球建议,并论证了其安全性、有效性和伦理问题。
此外,国际社会也保持对生命科学领域突发事件的关注,积极应对可能出现的风险。联合国教科文组织国际生物伦理委员会(IBC)和世界科学知识与技术伦理委员会(COMEST)联合发布的《关于新型冠状病毒肺炎的联合声明:全球视角下的伦理考量》表明,新冠肺炎疫情全球性大流行,急需全球生物伦理学的反思与应对。
我国生命科学领域伦理治理现状
生命科学领域伦理问题研究日益受到重视
国家/地方多项基金、计划支持生命科学伦理问题、政策和监管研究。国家社会科学基金项目2006 年以来资助生命科学领域伦理问题、法规、标准研究等相关项目超60 项,包括重大项目5 项、重点项目1 项。国家重点研发计划等科技类资助项目中设置配套课题支持伦理相关软科学研究,如2017 年精准医学研究专项项目“精准医疗伦理、政策法规框架研究”、2018 年合成生物学专项项目“合成生物学伦理、政策法规框架研究”等。
近年来我国生命科学伦理相关研究论文日益增长。截至2021 年8 月,中国学者参与发表在 Web of Science 核心合集的生命科学伦理英文文献96 篇,发表在中国知网(CNKI)的相关中文论文共1 290 篇;主要研究机构有中国科学院科技战略咨询研究院、北京干细胞与再生医学研究院科技伦理研究中心、华中科技大学生命伦理学研究中心、复旦大学哲学学院等,主要研究内容包括生命科学领域新技术、新理念、新应用相关的伦理争议、伦理反思、伦理审查、法律规制等。
社会各界不断呼吁要正视生命科学领域的伦理问题,加强伦理监管。2018 年中国科学技术协会生命科学学会联合体发表声明,坚决反对有违科学精神和伦理道德的科学研究与生物技术应用;2019 年5 月,我国4 位伦理学家在 Nature上发表评论文章,呼吁加强对生物医学研究的伦理监管,并提出重建我国科技伦理治理体系的6 个方面政策建议;2019 年和2021 年全国两会上多位代表强调要重视生命伦理规范,建议要加强立法来引导、约束生命科学领域科研活动,提高处罚力度。
伦理相关法律法规相继出台,监管制度发展与时俱进
我国逐渐重视生命科学领域伦理监管,出台多项新兴技术应用的伦理监管举措。《人胚胎干细胞研究伦理指导原则》(2003 年)、《涉及人的生物医学研究伦理审查办法》(2016 年)、《人体器官移植条例》(2017 年)、《医疗技术临床应用管理办法》(2018 年)、《医疗纠纷预防和处理条例》(2018 年)、《生物医学新技术临床应用管理条例(征求意见稿)》(2019 年)等政策法规对相关研究和临床活动进行伦理约束,禁止不符合伦理规范的研究和实践活动。
生命科学领域伦理相关立法层次逐渐提高。近年来,生命科学领域相关伦理规范逐步被写入《中华人民共和国基本医疗卫生与健康促进法》《中华人民共和国民法典》《中华人民共和国生物安全法》《中华人民共和国刑法》等法律法规,尤其值得一提的是2020 年《中华人民共和国刑法修正案(十一)》新增非法进行人类基因编辑、克隆罪,明确了国家对于非法进行人类基因编辑、克隆行为的监管立场。这些法律条款从总体国家安全法律体系下,对生命科学领域的伦理监管与治理进行宏观指导和规范,对生物技术研究、开发与应用活动、生物医学临床研究设立了明确的伦理规范要求——不得危害人体健康,不得违背伦理道德,不得损害公共利益。
伦理审查规定不断更新,多层级伦理审查机构建设逐渐完善
涉及人的生命科学与生物医学研究伦理审查制度不断更新。《涉及人的生物医学研究伦理审查办法》(2016 年)已建立了较为系统的涉及人的生物医学研究的伦理审查制度,规定了涉及人的生物医学研究伦理审查原则,各级伦理委员会的设置和职责,伦理审查的程序、方法,以及审查的监督与管理等。2021 年4 月,国家卫生健康委员会结合新的形势和要求,会同有关部门起草了《涉及人的生命科学和医学研究伦理审查办法(征求意见稿)》,将适用对象由生物医学研究扩展至生命科学和医学研究;更新立法依据,强调人的尊严、隐私保护,强化知情同意;并强调对于公共利益的保护。
多层级伦理审查机构建设逐渐完善。随着相关政策及管理办法相继发布,我国的生命科学伦理审查委员会及相关独立机构建设逐渐完善。对于涉及人的生物医学研究领域形成了国家医学伦理专家委员会、省级医学伦理专家委员会和机构伦理委员会3 个级别的医学伦理审查结构。此外,各省级卫生行政部门设立本行政区域的伦理审查指导咨询组织,由此出现了新类型的伦理委员会,如生殖医学伦理委员会、人体器官移植技术临床应用与伦理委员会;各省市和地区相继成立了多个区域伦理委员会,以满足不具备伦理审查条件的机构开展委托审查,使我国的伦理委员会机制更加完善。
我国生命科学伦理治理的问题与挑战
生命科学伦理立法相对滞后,难以及时发挥约束作用。法律法规是政府治理科技伦理的强制性工具,具有刚性约束的作用。我国经过近30 年的发展,虽相继出台了《人胚胎干细胞研究伦理指导原则》《涉及人的生物医学研究伦理审查办法》《涉及人的生命科学和医学研究伦理审查办法(征求意见稿)》等生命科学领域的伦理治理部门规章,相关伦理规范也逐步被写入《中华人民共和国基本医疗卫生与健康促进法》《中华人民共和国生物安全法》《中华人民共和国刑法》等上位法,但生命科学前沿交叉的学科属性决定了相关新技术和新问题层出不穷。例如,合成生物学、人工智能等新兴领域涉及的伦理问题错综复杂,而我国的现有伦理治理法律法规相对滞后,无法及时化解风险和矛盾,多处于“事后止损”阶段,呈现出执行力度弱、法律法规不适用等现实问题。
机构伦理委员会监管作用不到位,人力与资金缺乏。在我国建设“国家科技伦理委员会”的大背景下,目前,重点高校相继建立了自己的科技伦理委员会,对涉人科技伦理、实验动物伦理等领域开展了针对性监管。但相比美国及欧洲一些国家,伦理审查在我国生命科学领域的科技项目立项与开展中的重要性并未获得充分的认识,缺乏专门的人员与资金配置,存在人员兼职及审查流于形式等情况;伦理委员会的独立性未得到充分保障,伦理审查的内容缺乏规范性,后续的跟踪审查也缺乏持续性,机构层面的监管作用有待进一步提升。
研究人员自律意识不强,需提升伦理培训。研究人员的伦理治理贯穿了科研的整个流程,从实验设计、研究实施到结果分析,再到最后的成果发表与成果转化,整个过程中均应严格遵守道德操守和科研伦理。而在声名、财富和地位等因素的影响下,部分研究人员出现自律意识松懈,伦理价值判断缺失或偏离,并产生严重违背科研伦理的事件,为伦理治理带来挑战。此外,我国的高校与研究机构虽然已开展相关的科技伦理培训,但未建立常态化的伦理与安全培训、考核机制,未能切实落实培训的参与度与时效性。
公众伦理治理参与度低,科普力度有待加强。生命科学技术的伦理治理不仅在于如何对科学研究人员和临床医学工作者进行有效引导和管理,还应让更多的公众参与进来进行讨论。生物技术涉及一些非常敏感的话题,推动其未来在临床上应用,需要更多的研究以及社会共识。公众是伦理治理体系的重要组成部分,保证公众的权益,促进公众对科学研究和应用的理解已成为重要趋势。目前,按照伦理委员会人员组成要求,公众已参与其中;但因缺乏必要的科普培训,公众在参与具体事务时不具备相应能力,且积极性不高。科学家作为技术的实际创新人员相比于媒体更能够客观、公正地表达技术最“真实”的一面,使公众对新兴技术有全面的认识;但是,基于保密性需要,以及干扰日常科研工作等原因,我国一些科学家并不热衷于参与科普工作。
关于我国生命科学领域伦理治理的思考与建议
生命科学研究的开展必须受到伦理的规范和引导。伦理制度的建立能够保证科研创新更有序地开展,保持二者间的张力与平衡,是未来生命科学发展与伦理全面进步的基础。生命科学领域的伦理治理体系涉及多个利益主体,我国生命科学领域的伦理治理需要考虑到各方的利益与诉求,形成政府、研究机构、科研人员、产业、社会公众“协同共治”的伦理管理体系。
政府层面:加快构建伦理先行的科技创新体系。政府是生命科学领域伦理治理规则、政策的制定者,应加快构建伦理先行的科技创新体系。面对生命科学领域层出不穷的新兴技术风险,政府需在第一时刻分析技术特点,对可能出现的伦理问题主动干预,构想技术应用场景。进而,应研判技术发展趋势,建立明确的科研伦理法律或规则,在规避生命伦理风险的同时保证科研及临床转化工作的顺利开展,为高校、研究机构、企业等制定科研伦理规章制度提供指引。可参考英国、德国等国就生命伦理管理建立针对性的法律文件。通过完备的、有强制力的指导性法规,对违反规定的人员与机构建立明确的问责制度,并在一定范围内赋予伦理管理单位行政主体的资格,对研究人员及科技成果使用者的行为加以约束。将参与国际伦理议题讨论和国际伦理规则制定纳入建设世界科技强国的重要内容,尤其是伦理争议大的新兴科技领域。提升我国在生命科学伦理治理中的国际话语权,让中国的伦理思想及话语成为国际伦理治理的重要逻辑组成部分。
机构层面:发挥监督管理主体作用。高校、科研机构、医疗机构是生命科学领域伦理治理的监督与管理者,有权监督科研行为,也有责任坚守伦理规范。“基因编辑婴儿”事件后,许多高校成立了科技伦理委员会,医疗机构一般设有临床试验伦理委员会。为了有效发挥机构监督管理主体的作用,高校、科研机构、医疗机构等均需设立专门部门以加强科技伦理日常管理;并建立常态化工作机制,对机构科技活动的生命伦理风险主动研判、及时化解。此外,机构需加强科学家生命伦理教育培训,帮助科研人员识别生命科学技术研究和应用中的伦理问题、掌握伦理分析决策的方法,帮助科学家合乎伦理地开展科研活动。
研究人员:加强伦理自治和自我约束。研究人员是生命科学领域伦理治理的关键行为者。研究人员需积极履行伦理准则,严格遵守国家、地方与机构的科研伦理规章制度。对于尚未建立规章制度的新兴生物技术领域,国际社会积极呼吁科学家通过多种类型的自治或自律约束参与治理,充分发挥科学共同体的自治作用和科学传播作用。同时,树立良好的科研伦理意识,自觉自律,是研究人员开展伦理自治的关键。因此,研究人员需积极参与相关伦理培训,强化科研诚信,明确个人研究领域的伦理风险与道德责任,增强研究过程的风险防控意识。
行业层面:形成伦理共识有序发展。市场是生命科学领域伦理治理的矛盾中心,很多生命伦理问题的发生根源即在于商业化过程中个人经济获益与社会群体福祉的冲突。我国的医药产业正处于巨大变革之中,而医药产品具有极强的商品性和社会性。因此,行业协会等社会组织作为独立的第三方,需要积极发挥自身的专业优势,发挥同行评议和同行监督的作用。由行业协会与企业团体建立行业层面的伦理共识,明确一些生命科学“敏感”地带的成果转化路径与商业化渠道,明确医药市场的“伦理红线”,以从利益产出端约束科研创新行为,促进中国乃至全球医药行业健康发展。
公众层面:共同参与伦理治理生态建设。公众是生命科学领域伦理治理的见证者与参与者,建设公众层面共同参与治理的伦理生态至关重要。伦理委员会的伦理审查需要加强对非医学、非科学委员的伦理培训,提升非医学、非科学委员对伦理项目审查的专业性与客观性。生命科学的伦理治理生态建设需要更加重视“公众对话”。我国需积极发挥媒体与互联网在伦理治理中的作用,搭建新兴技术与公众对话的平台,由科学家、伦理学家、社会学家、研究机构、政府主管部门共同参与,广泛听取公众的意见,鼓励公众了解生命伦理,并积极参与科研伦理治理活动,监督并抵制生命科学中的科研失范行为。在科学家层面,科技管理的政府部门需要进一步调动科研人员参与公众对话与科普工作的积极性,将“科普成就”列入科学家的评估系统,鼓励科学家从专业层面给予新兴生物技术正确地“技术定位”与“舆论导向”。
建立具有“中国特色”的伦理治理体系。由于生命科学领域的伦理治理机制和方法主要是“舶来品”,西方的治理体系虽然提供了有益的视角,但不能完全解决我国面临的问题。因此,在伦理制度的制定过程中,要考虑到我国的实际国情,根据各地不同的经济发展基础与科学发展水平因地制宜、建立健全相关法律法规,规范伦理审查行为。此外,我国的伦理建设还需传承我国传统文化中优秀的伦理价值观,契合我国从古至今“重生”“贵生”或“生命价值”的文化形态,从中国传统和现实问题出发,揭示并阐述生命科学伦理治理中的中国文化观点,并将这些观点融入伦理制度的每一个环节,创造一个满足科研与产业规范发展且兼备人性温暖的具有“中国特色”的生命科学伦理治理体系。 (《中国科学院院刊》供稿)
